2021年5月24日, Journal of Cell Biology在线发表了bat365官网登录入口生命科学中心杨崇林教授实验室题为“The Rab7 effector WDR91 promotes autophagy-lysosome degradation in neurons by regulating lysosome fusion”的研究论文。本研究揭示了WDR91作为小GTP酶Rab7的效应因子在神经元自噬-溶酶体降解通路中发挥作用的分子机制。
内吞体-溶酶体及自噬-溶酶体通路对神经元发育和稳态的维持至关重要。杨崇林课题组的前期系列研究发现了线虫中的两个蛋白SORF-1和SORF-2,它们形成一个复合体抑制了PI3K激酶活性从而促进早-晚期内吞体转化。SORF-1和SORF-2的人类同源蛋白WDR91和WDR81以同样的机制发挥作用 (Liu K et al., 2016, J. Cell Biol.212(2):181-198)。进一步研究发现WDR91是Rab7的一个新的效应因子,在神经元的发育过程中发挥不可或缺的作用 (Liu K et al., 2017, J. Cell Biol.216(10):3307-3321),而WDR81则促进了泛素化蛋白聚集体通过选择性自噬被清除(Liu X et al., 2017, J. Cell Biol.216(5):1301-1320)。杨崇林课题组和中科院遗传所郭伟翔课题组合作揭示了WDR81–SARA–TGFβ轴对成体神经发生的重要性,并从成体神经发生的角度解析了CAMRQ2 综合征的发病机制 (Wang M et al., 2018, Mol Psychiatry. 26(2):694-709.)。
在本研究中,杨崇林课题组和中科院遗传所郭伟翔课题组合作揭示了WDR91的另一重要功能—溶酶体融合及稳态的调控。Wdr91脑组织特异敲除的小鼠展现出渐进性的运动和行为缺陷,并伴随着大量皮层神经元的死亡及异常增大的溶酶体/自噬溶酶体的累积。进一步的研究发现WDR91作为小GTP酶Rab7的效应因子,竞争性抑制了Rab7对另一个效应分子VPS41的招募,从而限制了溶酶体的过度融合,保障其正常的降解功能。该研究表明WDR91作为小GTP酶Rab7的效应因子,通过维持适度的溶酶体融合从而在溶酶体稳态和神经元自噬降解过程中发挥不可或缺的作用。
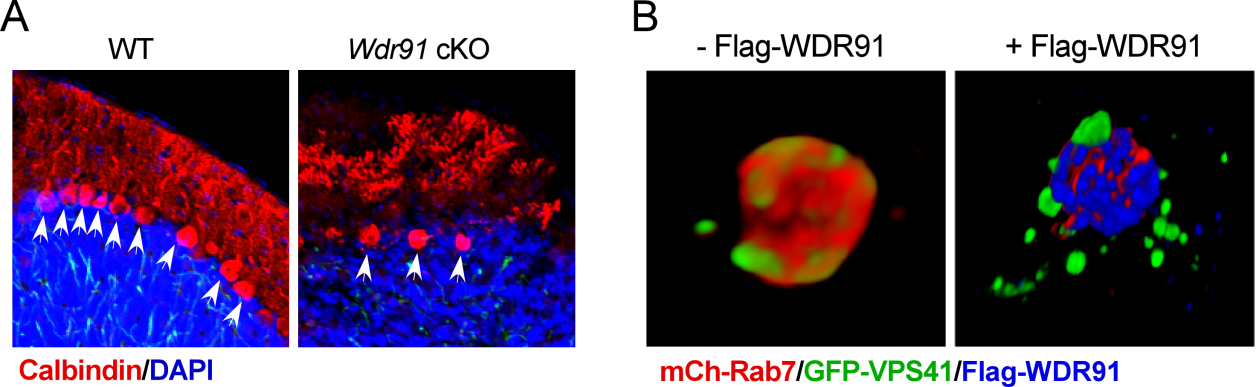
A. Wdr91神经元特异敲除的小鼠浦肯野细胞数量显著降低; B. WDR91抑制Rab7对VPS41的招募。
杨崇林教授、中科院遗传所郭伟翔研究员和周合江为该论文的共同通讯作者。郭伟翔研究组的博士邢茹晓和杨崇林研究组助理研究员周合江为该论文的共同第一作者。本研究得到国家自然科学基金委、国家重点基础研究发展计划、云南省科技厅及北京脑计划研究项目的资助。
鉴于杨崇林教授实验室在溶酶体研究领域内的长期累积和突出贡献,Journal of Cell Biology特邀杨崇林教授评述该领域近期重要发现。本月四号,由杨崇林教授和中科院生物物理所王晓晨研究员共同撰写的题为“Lysosome biogenesis: regulation and functions”的长篇特邀综述于Journal of Cell Biology在线发表。该文系统地评述了溶酶体发生的调控机制,其中包括溶酶体蛋白的合成与运输、溶酶体的再生、溶酶体发生的转录性调控等机制。并对溶酶体发生应对营养条件、细胞周期、干细胞休眠、细胞命运决定的调控以及对个体发育和衰老的调控机制进行了详细阐述。
该文由杨崇林教授及中科院生物物理所王晓晨研究员共同撰写。本文得到国家自然科学基金委、科技部、中科院战略先导计划及云南省科技厅的经费资助。


